流感疫苗不良事件通報現況
- 通報系統與流程:台灣設有「疫苗不良事件通報系統(VAERS)」,民眾或醫事人員若懷疑接種流感疫苗後發生不良事件,可主動通報。這些資料會交由食藥署及藥害救濟基金會進行安全訊號偵測與分析,並定期公布評估結果。
- 通報定義:不良事件通報是指「接種疫苗後任何時間,通報者懷疑或無法排除與疫苗相關之任何事件」,這類事件僅有時序關係,未必有因果關係。
- 近期通報數據:以114年度(2025年)為例,截至10月7日,全國共施打約128.1萬劑季節性流感疫苗,僅接獲1件不良事件通報,平均每十萬劑通報數約0.08件,顯示通報率極低。
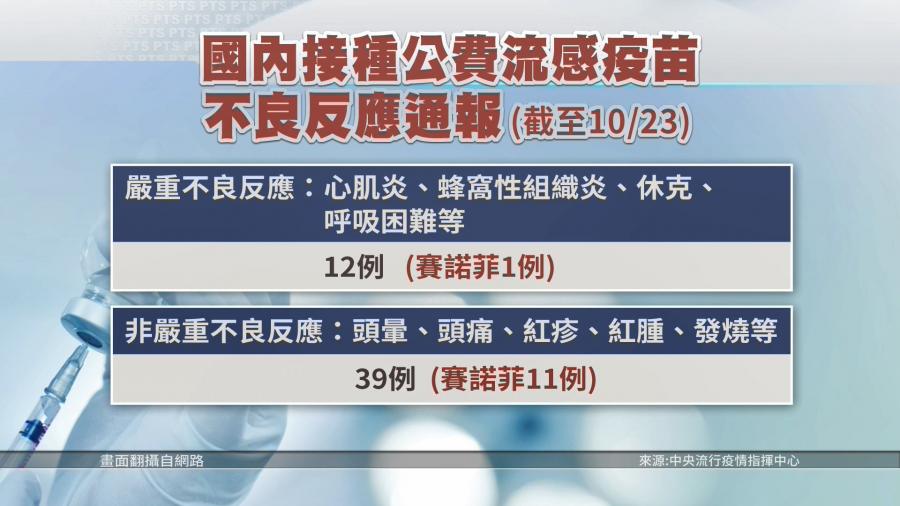
- 通報品質與追蹤:超過90%的不良事件通報屬於非嚴重不良事件,但對於嚴重或特殊關注不良事件(如GBS、過敏性休克等),會進行病例查證與追蹤,並串聯健保資料庫主動監測。
流感疫苗安全性評估
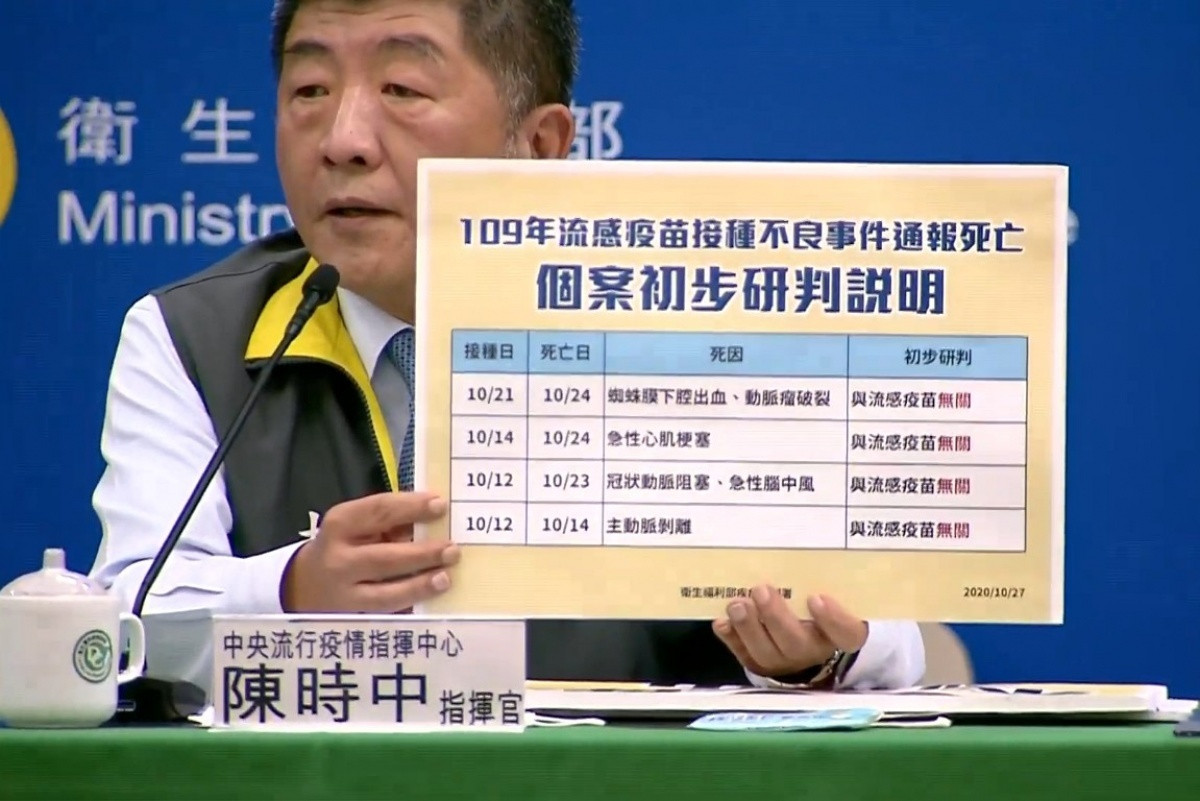
- 因果關係釐清:通報的不良事件需經專業評估,釐清是否確實由疫苗引起。多數通報事件僅為時序相關,實際因果關係需進一步流行病學研究確認。
- 監測目標:即時發現與評估疑似不良事件,快速判斷是否與疫苗相關,並監測特定嚴重不良事件發生率是否高於背景值。
- 安全性數據:根據歷年統計,流感疫苗不良事件通報率低,且嚴重不良事件未顯著高於預期背景值。例如,112年度公費流感疫苗接種656.2萬劑,共通報113件不良事件,顯示整體安全性良好。
- 國際經驗與架構:台灣的疫苗安全監測架構與國際(如美國CDC)類似,結合被動通報與主動資料庫追蹤,並針對特殊關注不良事件進行重點監測。
常見不良反應與處置
- 常見反應:接種部位紅腫、疼痛、發燒、疲倦等輕微反應較常見,通常1-2天內緩解。
- 嚴重不良反應:如急性過敏、休克、GBS(格林巴利症候群)等雖罕見,但需即時通報與處置。
- 處置原則:輕微反應可觀察或症狀治療,嚴重不良反應需立即就醫並通報。
小結
台灣流感疫苗不良事件通報系統完善,通報率低,且多數為輕微反應。對於嚴重或特殊不良事件,有嚴謹的監測與評估機制,確保疫苗安全性。民眾接種流感疫苗整體風險低,效益大於風險,符合國際疫苗安全監測標準。





![[生活]TIDDI鈦迪-超低噪音【翻轉式冷暖扇(EcoAir330)】Cindy開箱](https://d1ig8jhxcd4h04.cloudfront.net/posts/ppdln7/banners/elkwz6_600.jpg)






